奇点糕个人认为,在带来对生命认知的革新之外,技术自身也具有独特的魅力。比如说我就非常喜欢光遗传学(optogenetics)——用光操纵神经元,甚至能够达到造物主所设定的精确度,这本身不就是一种宏大的浪漫吗?
光只是技术的直接介质,在类似的思路下,是不是还能够出现更多的同类技术呢?
比如,声遗传学(sonogenetics)?
近期,《自然通讯》杂志发表了Salk研究所Sreekanth Chalasani科研团队的成果,研究者们找到了能够在哺乳动物中起效的声敏通道蛋白TRPA1,7mHz超声波能够有效激活神经元,调控小鼠肢体活动[1]。
这无疑是声遗传学登上科学舞台的重要开场。

几年前Edward Boyden终于将光遗传学的精确度提升至单个神经元,我当时激情澎湃地写了篇长文来“吹彩虹屁”(就是开头超链那一篇),文末提到光不过是控制细胞的介质,采用其他的介质,声遗传学、磁遗传学、纳米遗传学也不是做梦。
其实道理说来真不难,光遗传学的关键在于寻找到合适的光敏蛋白,将光信号“翻译”给细胞,那么如果能找到一个类似的声敏蛋白,声遗传学就有操作空间了。
想出这个点子的可不是我,正是今天介绍这篇论文的通讯作者Chalasani。大约十年前,他提出了使用超声波刺激特定细胞群的想法,并发明了“声遗传学(sonogenetics)”这个词。
2015年,他的研究小组在秀丽隐杆线虫中发现,TRP-4就是那个梦寐以求的声敏蛋白,使用医学检查常用的超声频率就能通过TRP-4激活线虫神经元[2]。
但是特别遗憾的是,TRP-4在哺乳动物细胞中并不起效。
按理说已经发现的对超声敏感的蛋白也不少了,比如说Piezo、Prestin、TRP和TREK超家族,但它们激活的条件、在不同物种细胞中的效果都相差甚远,从前人的研究成果中几乎找不到突破口。
于是研究者们决定还是使用“笨方法”——就挨个筛选吧。
他们首先确定了目标的超声频率。低频超声虽然穿透生物组织的能力更强,但是聚焦能力比较差,很难精准地靶向特定的大脑区域。
两边权衡,研究者们最终选定的是7MHz,能聚焦到107μm³,适合在啮齿动物中做实验。而且这个频率也不会导致空化效应(cavitation)(就是超声波洗眼镜的招数),免得损伤细胞。
 不同频率超声的聚焦能力和穿透能力
不同频率超声的聚焦能力和穿透能力然后就是无尽地筛选了……还是有尽头的,这项研究里研究者们一共盘了191种候选蛋白,每种都连着荧光报告基因一起转染到人胚胎肾细胞(HEK),HEK细胞表达钙指示剂,可以监测细胞内钙离子的流动。
没用的结果不多说了 ,最终选出声敏通道蛋白竟然是个老熟人,TRPA1。
我震惊啊,这玩意不久之前还见过,去年诺贝尔生理学或医学奖就有它一份啊。TRPA1是经典的伤害感受蛋白,真没听说过它还对超声敏感。
以及TRPA1在小鼠中的同源物效果就不是很好,非哺乳动物同源物更是完全不受超声调控,差别是挺大的。
无图无真相,给大家看一个会动的。超声刺激后,HEK细胞内钙离子水平骤升,在钙指示剂作用下红得发光!(i荧光蛋白就是我!)

钙离子内流是啥啊,放在神经元上不就是动作电位吗,有戏,太有戏了。
实际在神经元上表达TRPA1,研究者们真的观察到了动作电位的产生。
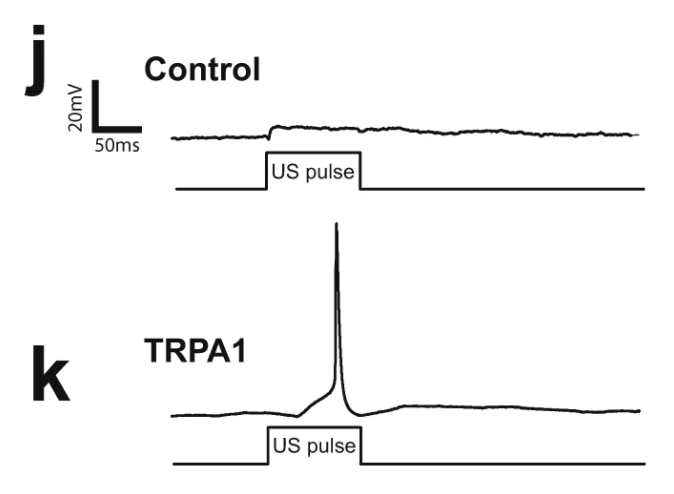 动作电位!
动作电位!以及,好看动图,再来一次!

研究者还试着在小鼠里做了实验,超声真的能够刺激小鼠的神经元,使小鼠单侧肢体发生动作。

当然了,这个研究的实际成果可以说还是相当的初步,距离光遗传学那样成熟的应用还相当比较的远。这还要靠后续对TRPA1声敏机制的探索和改造了。这项研究给出的初步结论是,TRPA1的光敏作用与N端结构域、肌动蛋白细胞骨架及胆固醇相互作用有关。
对于声遗传学的应用,Chalasani和同事们已经有了一些想法。比如目前用于治疗帕金森病和癫痫等疾病的深脑电刺激(DBS)技术,就是可以通过声遗传学来实现无创的;再比如使用声遗传学来激活心脏的特定细胞,这就是一种无需植入的新概念心脏起搏器了。
我已经迫不及待啦!
参考资料:
[1]https://www.nature.com/articles/s41467-022-28205-y
[2] Ibsen, S., Tong, A., Schutt, C., Esener, S. & Chalasani, S. H. Sonogenetics is a non-invasive approach to activating neurons in Caenorhabditis elegans. Nat. Commun. 6, 8264 (2015).
[3] https://www.sciencedaily.com/releases/2022/02/220209093410.htm



